Emerging Microbes & Infections | 段广才团队首次建立从手足口病患者中分离出的CVA19经口感染小鼠模型
发布时间:2023-11-11作者:管理员
近日,郑州大学公共卫生学院段广才团队在EMERGING MICROBES & INFECTIONS上发表题为 A mouse model and pathogenesis study for CVA19 first isolated from hand, foot, and mouth disease的研究论文。该研究首次从一名手足口病患者中分离出一种自然适应小鼠的CVA19毒株,并成功建立了基于7日龄ICR小鼠的经口感染模型,该小鼠表现出与人类感染相似的腹泻和脑脊髓炎症状。该研究建立了一种模拟自然感染途径的小鼠模型,为研究CVA19的发病机制和评估疫苗或抗病毒药物的疗效提供了可靠的动物模型。

几十年来,由人类肠道病毒(HEVs)感染引起的手足口病(HFMD)的暴发已成为全球公共卫生问题。HEV是引起全身表现的常见病原体,属于小核糖核酸病毒科,包括四种肠道病毒(即 HEV-A、HEV-B、HEV-C 和 HEV-D)。在肠道病毒中,柯萨奇病毒与多种疾病有关,包括手足口病、无菌性脑膜炎、急性弛缓性麻痹、急性弛缓性脊髓炎、结膜炎、脑炎、心肌炎、呼吸系统疾病和腹泻。柯萨奇病毒A19(CVA19) 是一种正义单链 RNA 病毒,属于HEV-C 组。多项研究报告称,CVA19 在许多国家引起急性胃肠炎,例如印度,泰国,日本和法国等。然而,与其他嗜神经性HEV一样,CVA19也可导致无菌性脑膜炎、急性弛缓性麻痹,证明其能够直接感染中枢神经系统。最近,CVA19感染的手足口病病例被首次报道,表明CVA19已经成为手足口病的一种新发病原体。鉴于CVA19的神经嗜神经能力,CVA19的爆发可能会造成更严重的后果,应引起重视。不幸的是,迄今为止,针对CVA19感染的预防和治疗药物尚未得到很好的开发。动物模型为理解人类疾病提供了不可或缺的工具。因此,开发合适的动物模型将极大地促进CVA19的发病机制,并随后为该疾病的治疗和预防提供有价值的信息。
本研究发现,该CVA19毒株自然适应小鼠,CVA19经口感染后,小鼠出现体重减轻、肢体无力或挛缩症状,肢体受累程度从单瘫到四肢瘫痪不等,导致爬行能力下降,且呈现年龄和剂量依赖性,最终确定基于7日龄小鼠更适合模拟CVA19感染(图1)。
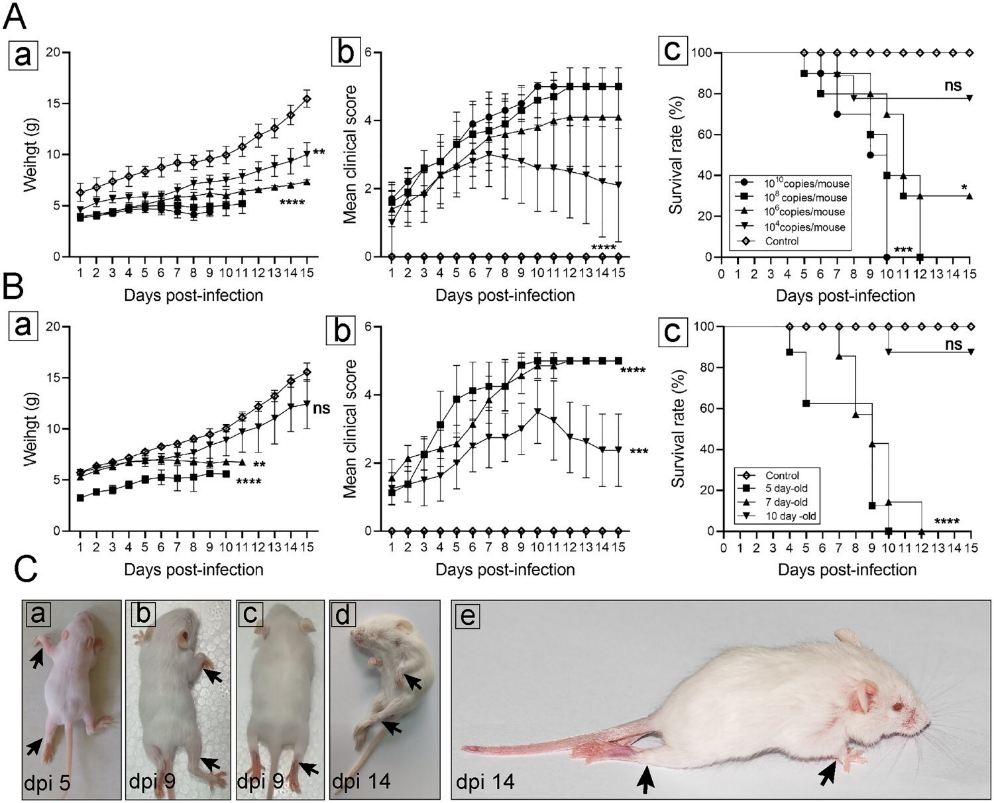
图1. 小鼠CVA19感染模型的建立
为确定7日龄小鼠通过口腔感染CVA19后病毒传播的动态模式,采用qPCR分别检测3、5和8 dpi时,感染小鼠脑、肺、心脏、肝脏、脾脏、肠、肾脏、肌肉、血液和脊髓中的病毒载量。在骨骼肌中,病毒载量较高,比其他组织或器官高3-5个数量级,表明肌肉趋向性,然而脊髓和大脑中的病毒载量在不同时间点均相对较低。病毒繁殖的时间过程实际上与小鼠的临床表现相对应(图2)。
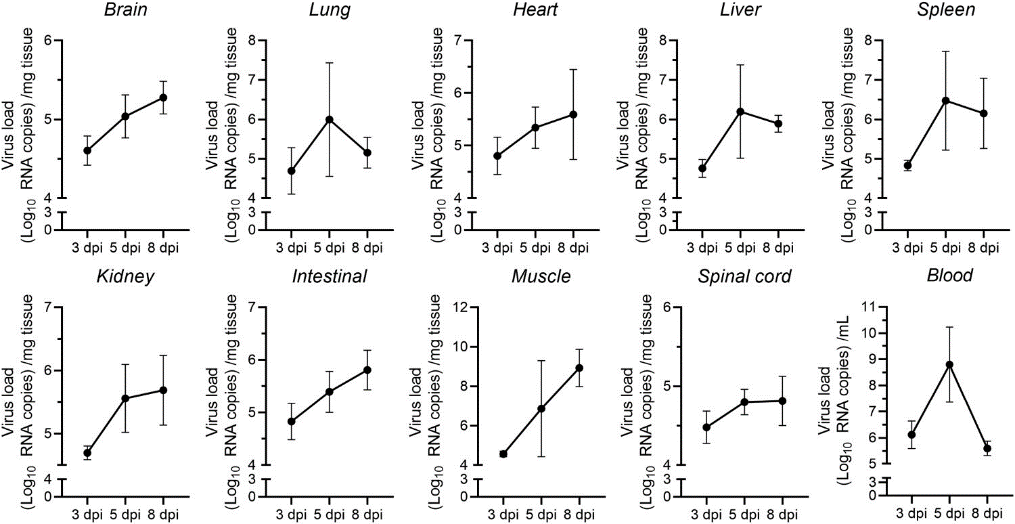
图2. CVA19感染后多种器官中的病毒载量
肠道病毒感染中枢神经系统通常与无菌性脑炎等严重疾病有关。被感染小鼠的脑神经元排列无序,Nissl的体数略有减少,为了确定CVA19是否可以感染脑神经元,实验人员对病毒RNA和NeuN(神经元的一种特异生物标志物)进行了免疫荧光共定位,观察到病毒RNA的荧光信号弥漫性分布在受感染大脑的神经元(主要在大脑皮层、海马体、丘脑)及星形胶质细胞,可见CVA19可直接感染小鼠大脑的神经元和星形胶质细胞,并进一步诱发神经系统疾病(图3)。
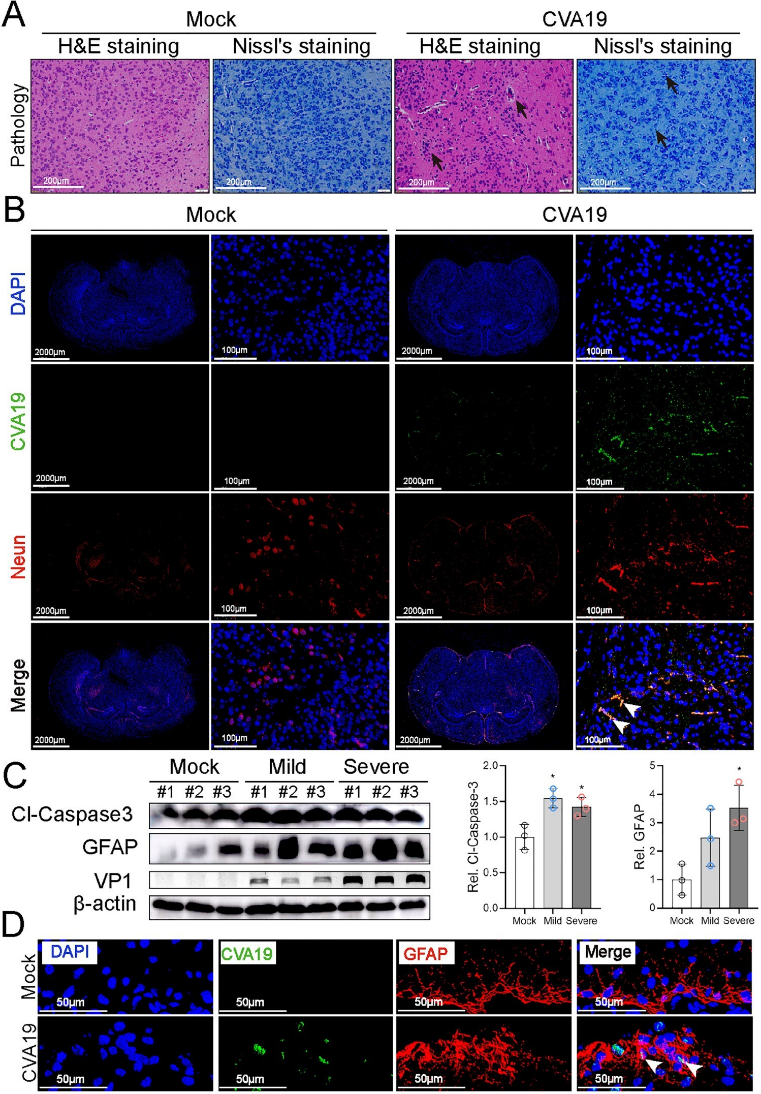
图3. CVA19直接感染脑神经元并诱导神经病理损伤
此外,肠道病毒感染相关急性弛缓性麻痹的主要损伤部位是脊髓前角细胞。前角运动神经元以胆碱乙酰转移酶(ChAT) 和 NeuN 的共定位为标志。实验人员使用荧光原为杂交和免疫荧光标记的方式在脊髓前角运动神经元中追踪到了病毒的踪迹,且运动神经元的减少与肢体瘫痪相对应,因此CVA19 可直接感染运动神经元,并导致急性弛缓性麻痹症状(图4)。
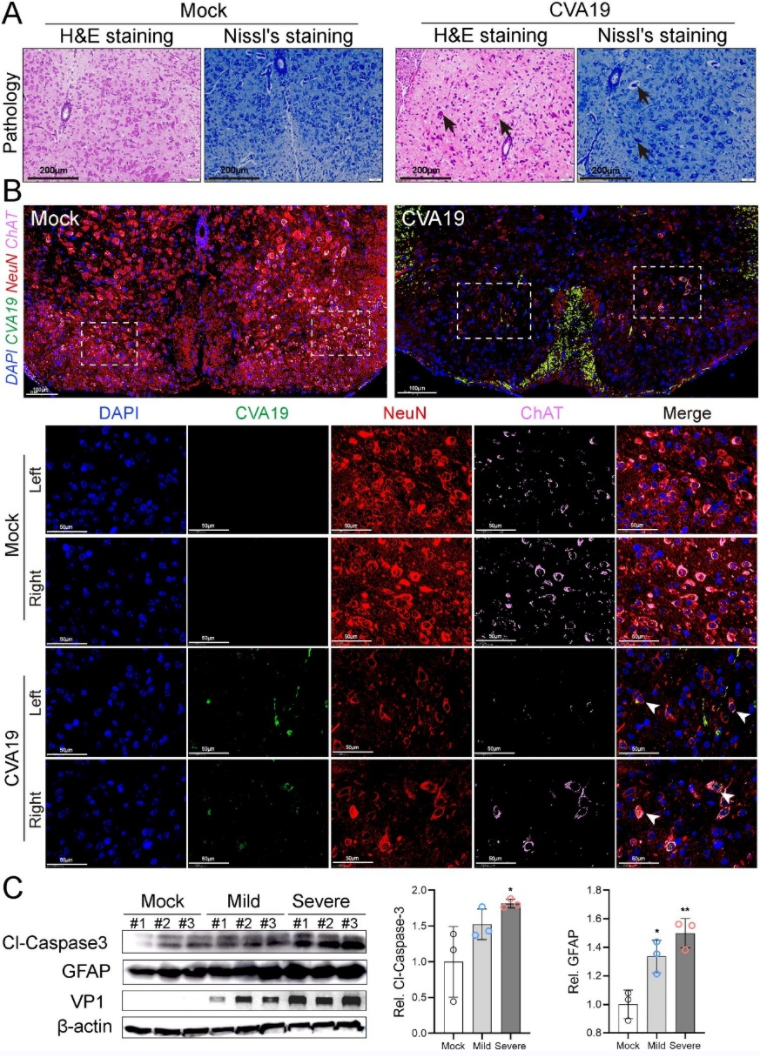
图4. CVA19感染脊髓运动神经元
另外,作者还通过透射电镜对脊髓神经元进行了超微结构的观察。在CVA19感染的小鼠中,感染神经元呈现液泡数量增加、核皱缩、核膜凹陷、神经吞噬、尼氏体消失或减少等现象。高倍放大视野下显示CVA19颗粒在受感染的神经元中呈现恒定的尺寸和一致的亚结构,直径范围为25至40nm。总之,CVA19直接感染脊髓神经元,导致神经系统疾病(图5)。
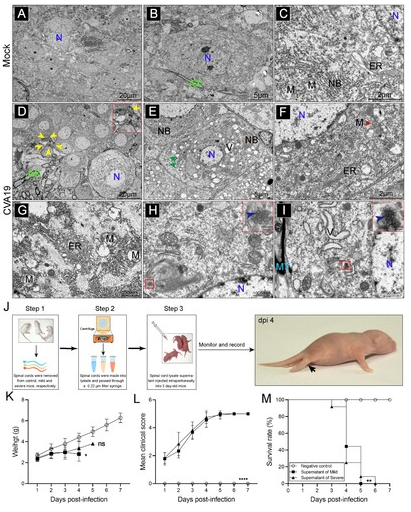
图5. 脊髓超微病理及科赫法则验证
此外,为了在一定程度上证明Koch假设,确定CVA19是否是小鼠麻痹性疾病的直接原因,以3日龄乳小鼠为感染对象,通过腹腔注射给予轻度和重度感染小鼠的脊髓裂解上清液。小鼠接种感染小鼠脊髓裂解上清液后,感染小鼠出现活动能力下降、肢体无力、瘫痪,平均临床评分逐渐升高,分别在5dpi(轻度上清液)和6 dpi(重度上清液)内死亡。对照组小鼠未见明显异常。总之,感染小鼠脊髓裂解上清液中所含的病毒导致新生小鼠肢体麻痹,表明CVA19在一定程度上是瘫痪的直接原因(图5)。
既往研究报道了CVA19感染可导致腹泻。为了探讨肠道损伤是否也是CVA19小鼠模型的一个特征,我们研究了CVA19感染对肠粘膜炎的影响。CVA19感染小鼠的小肠显示出绒毛缩短、炎性细胞浸润和组织结构完全破坏,导致广泛的损伤和较高的组织病理学评分。且采用免疫荧光标记发现了CVA19病毒RNA和cleaved-Caspase 3共定位在小肠绒毛细胞中,免疫荧光标记也显示,中性粒细胞等浸润到小肠组织增加,因此CVA19感染会导致小肠炎症损伤和腹泻(图6)。
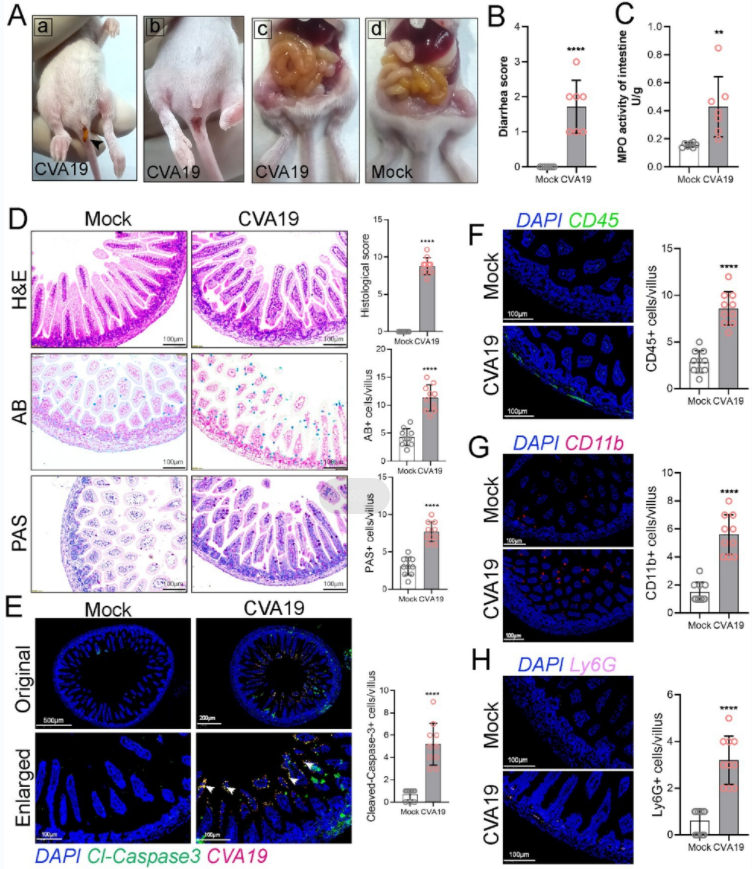
图6. CVA19 感染导致小鼠小肠炎症损伤和腹泻
免疫稳态失衡是病理损伤的主要原因之一。因此,我们分别在3、5、8 dpi 时,检测了对照组和CVA19感染小鼠外周血中的免疫细胞数量和细胞因子。结果表明CVA19感染可诱导全身炎症反应(图7)。
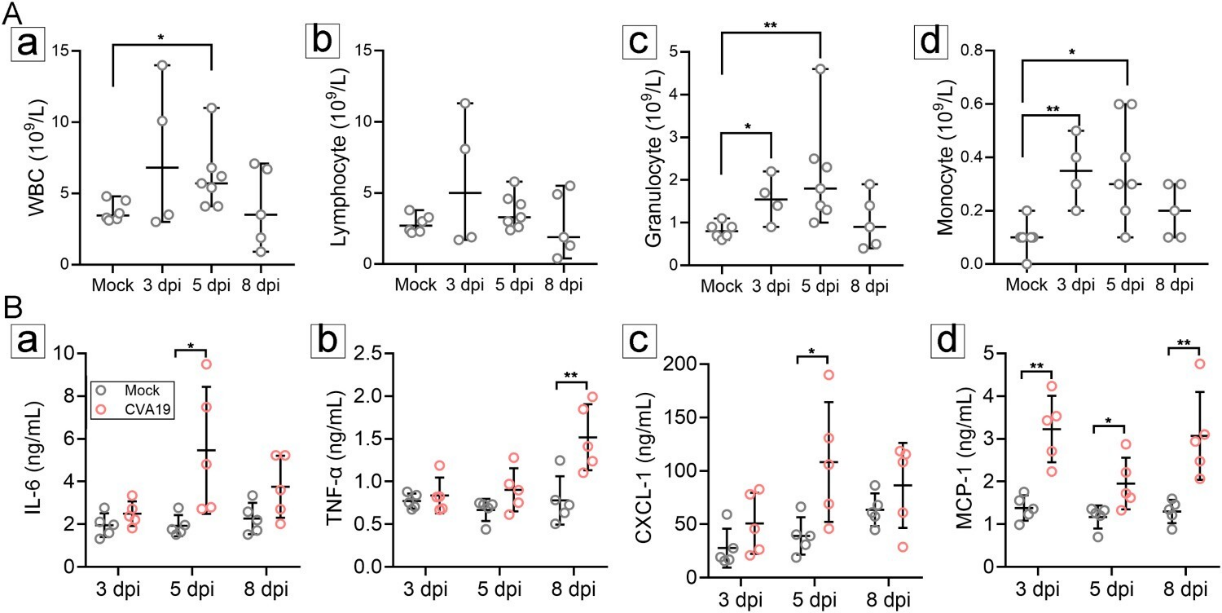
图7. CVA19 感染诱导全身炎症反应
最后,基于已经建立的动物模型,实验人员对常见药物及免疫制剂的抗病毒效果进行了评估,发现含有中和抗体的CVA19抗血清可预防CVA19感染引起的严重疾病,而利巴韦林和CVA19 VP1 单抗则无效,与此同时,与IFN-β治疗的小鼠相比,一些接受IFN-α2治疗的小鼠症状较轻,并避免了50%的小鼠死亡,因此重组IFN-α2也可减少 CVA19引起的严重疾病(图8)。
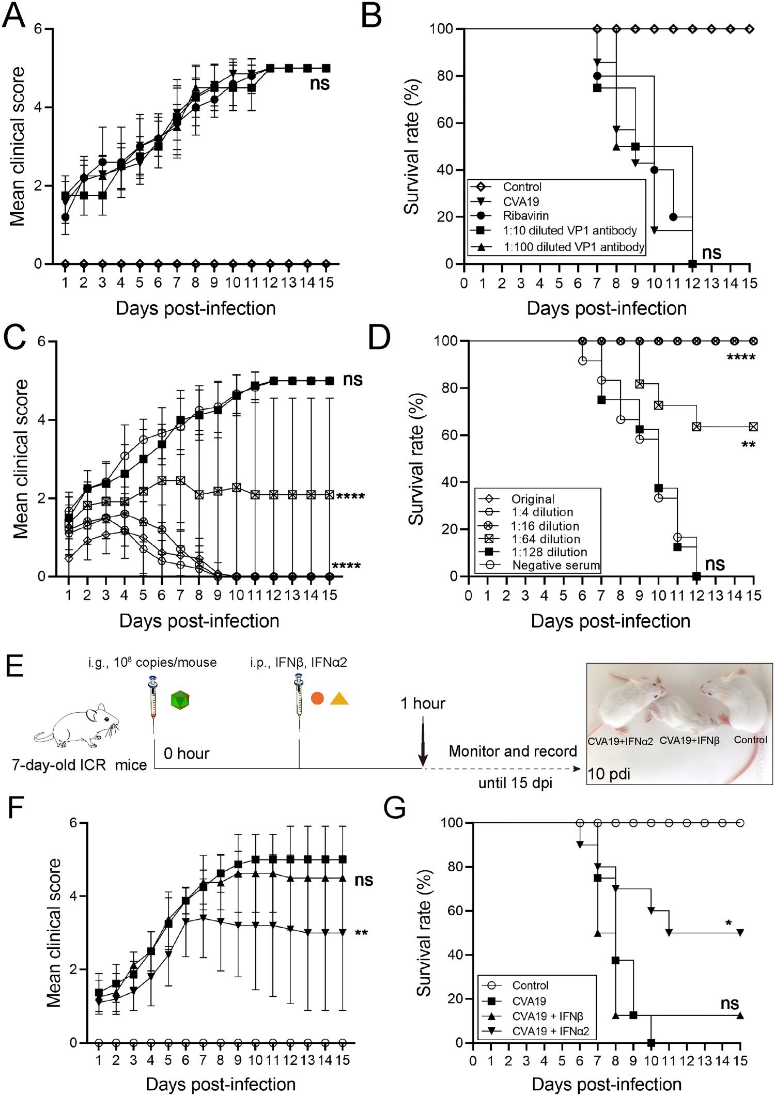
图8. 利巴韦林、免疫血清、单抗及干扰素抗病毒效果评价
综上,该研究首次建立了CVA19经口感染小鼠模型,成功模拟了腹泻和脑脊髓炎症状,这为研究CVA19的发病机制和评估疫苗和抗病毒药物的疗效提供了有用的工具。
郑州大学公共卫生学院段广才教授及青年教师晋乐飞副教授为该论文的通讯作者。郑州大学公共卫生学院纪望全博士为论文的第一作者。该研究得到了国家自然科学基金、中国博士后科学基金和河南高等学校重点科研项目的资助。
论文链接:
https://www.tandfonline.com/doi/full/10.1080/22221751.2023.2177084

